면역염색의 역사
실험을 하다 보면 많이 하게 되는 염색 중 하나인 IHC, 면역 염색은 내가 원하는 특정 단백질이 고정된 조직 안에서 존재하는지를 항체를 붙여 확인하는 방법이다. 현재까지도 육안, 광학현미경 아래에서 조직을 확인하는 방법은 널리 쓰이고 있는데 이 와중에도 내가 원하는 단백질을 육안으로 확인하고자 하는 시도들이 현재 면역염색의 발전에 근간이 되었다. 면역염색은 1940년대부터 시도 되었으나, 본격적으로 개발된 것은 1970년대이다. 이때 Tayler에게서 peroxidase를 이용한 면역염색을 하면 파라핀 고정을 한 조직에서도 면역 염색이 가능하다는 것이 알려졌으며 단일클론항체 제조법이 통용되기 시작하면서 다양한 primary antibody가 제작되었기 때문이다.
이후 면역염색은 '어떻게 비특이 반응을 줄이면서 정확하게 염색할수 있을까?' 라는 주제를 토대로 발전해왔다. 즉, 민감도와 특이도를 높이기 위해 발전해온 것이다.
면역염색의 방식
면역염색의 방식은 ELISA와 비슷하게 DIRECT 방식과 INDIRECT 방식이 있다. DIRECT 방식은 내가 원하는 항원에 항체를 직접 붙이고, 그 항체를 발색시켜 관찰하는 방법이고, INDIRECT방식은 1차 항체를 붙인 다음, 1차 항체에 비특이적으로 결합하는 2차 항체를 붙여 발색시키는 방법이다. 현재 사용되고 있는 방식은 대부분 indirect 방식이며, 이는 발색제를 넣은 비특이적인 항체인 2차항체를 넣어주기만 하면 되기 때문에, 간편하게 상용화가 가능했고 비특이 반응이 적게 나왔기 때문이다.
https://labanimal.tistory.com/19
면역염색의 종류
면역염색의 종류는 크게 '광학현미경으로 볼 수 있냐' 와 '형광현미경으로 볼 수 있냐' 로 나뉜다. 광학현미경으로 볼 수 있는 면역염색을 우리는 흔히 IHC (Immunohistochemistry)라고 부르며, 형광현미경으로 볼 수 있는 면역염색을 IF (
Immunofluorescence) 라고 한다.
이 두가지의 가장 큰 차이점은 2차 항체에 발색을 시키는 효소나 단백질이 붙어있는가, 아니면 형광이 붙어 있는가 이다. 효소나 단백질이 붙어 발색 과정을 거치고 볼 수 있으면 IHC이고,2차 항체에 형광이 붙어 형광 현미경을 통해 관찰할수 있으면 IF다.
이 중에 IHC에는 크게 세 종류가 있다. ABC와 PAP. 그리고 Polymer based 방법이다.
Avidin Biotin Complext method, ABC: 가장 많이 사용되고 있는 IHC 방법으로, 2차 항체에 biotin을 붙여 관찰하는 방식이다. 그림으로 살펴보면 다음과 같다,

1. 내가 보고자 하는 항체인 1차 항체를 항원에 부착시킨다. primary antibody

2. 그 위에 1차 항체에 비특이적으로 결합하는 2차 항체를 붙인다. 이 때 2차 항체에는 Biotin이 결합되어 있다. biotinylated secondary antibody
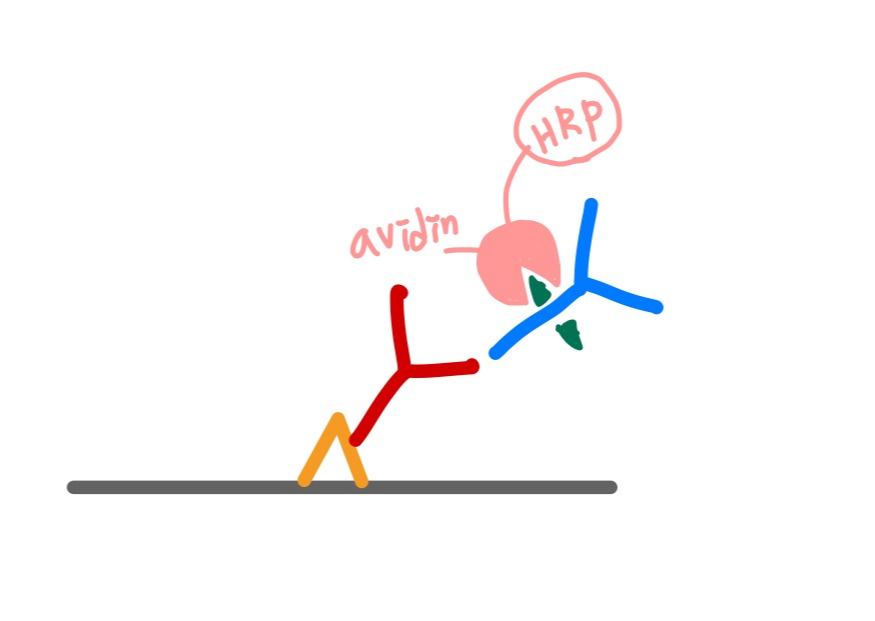
3. HRP (Horse radish peroxidase)가 conjugation 되어 있는 avidin을 첨가한다. avidin은 biotin과 결합한다.

4. 발색제인 DAB( 3,3′-Diaminobenzidine)으로 발색한다. DAB는 peroxidase에 의해 산화되어 갈색으로 발색된다.
PAP (Peroxidase, Anti-Peroxidase Method) : indirect 방법중에서 초창기에 사용되던 방법이다. 이 방법의 가장 큰 특징은 각 항체에 특이적인 PAP를 사용해야 한다는 점이다.

1. 내가 보고자 하는 항원에 1차 항체를 붙인다.

2. bridge가 되는 2차 항체를 붙여준다

3. peroxidase-anti peroxidase complex를 붙인다.

4.DAB로 산화시켜 발색시킨다.
마지막으로 설명할 방법인 Polymer based method는 가장 최근에 발전한 방법이다. 이는 dextran 구조에 효소를 붙여 발색을 시키는 방법으로 실험 시간은 줄이고, 민감도는 높인 방법이다.

1. 항원에 1차 항체를 붙이는 것 까진 똑같다.

2. Dextran polymer에 2차 항체와 HRP가 결합되어 있고, 이를 붙인뒤 DAB로 발색하여 관찰한다.
각 방법에는 장단점이 있어 이를 표로 정리해봤다.
| 장점 | 단점 | |
| ABC | 가장 상용화가 잘 이루어져 있으며, 용액의 보관이 용이하다. signal amplification이 잘 된다. 반응이 증폭되므로, primary antibody를 희석해서 사용 가능하다. |
체내에 잔존하는 biotin이 있는 경우 비특이 반응이 나타날 수 있다. 염색하고자 하는 위치에 따라 avidin-HRP complex가 침투하지 못할 수 있기 때문에 유의하여 사용하여야 한다. |
| PAP | 2차 항체나 1차 항체에 따로 붙이는 molecule없이 PAP만 구비하면 된다. signal amplification이 잘 된다. 반응이 증폭되므로, primary antibody를 희석해서 사용 가능하다. |
2차 항체 붙이고 PAP까지 붙여야 해서 시간이 많이 든다. 포르말린고정-파라핀으로 임베딩한 조직에게서 sensitivity가 떨어지는 경향이 있다. |
| Polymer-based | 2차 항체 붙이자마자 바로 발색하면 되니까 시간이 적게 든다. ABC 방법처럼 체내 비오틴과 결합할 일이 없어서 민감도가 높다. |
비싸다. 세포 구조물에 따라 Dextran polymerase가 통과하지 못할 수 있기 때문에 유의해서 사용해야 한다. |
포르말린 고정 파라핀 임베딩(FFPE) IHC, ABC 실시할 때의 유의사항
1. 가장 먼저 짚고 가야 할 것은, primary antibody 구매이다. 우리는 indirect 방법을 사용하므로, Tissue host와 antibody host는 반드시 달라야 한다. 아마 가장 먼저 실수 할 수 있는 부분일 것 같다.
Mouse 조직을 IHC 하기 위해선 > anti-mouse antibody가 아니라!! anti-rabbit, anti-rat과 같은 antibody를 구매해야 한다. 그 이유는 secondary antibody 때문이다. 2차 항체는 1차 항체에 비특이적으로 결합하기 때문인데.
마우스 조직-마우스1차항체-마우스2차항체 사용시에는 조직에 남아있는 기존 마우스 항체에 2차항체가 다 붙어버려 조직 전체가 염색이 되는 불상사가 일어난다.
마우스 조직-토끼 1차항체-토끼2차항체 사용시에는 토끼 1차 항체가 붙은 곳에만 염색이 되기 때문에 내가 원하는 항원-항체 반응만 관찰 할 수 있다.
마우스 항원에 토끼 항체가 붙을 수 있나요? 하고 물어본다면, 그건 항체마다 다르다. 항원에 대한 epitope 정보가 비슷하다면 가능한 것이다. 이는 각 항체를 판매하는 판매처 사이트에서 reactivity를 보고 구매할 수 있도록 되어 있다.
2. 면역염색의 가장 큰 어려운 점은 '조직마다' '개체마다' 프로토콜을 다르게 설정해야 한다는 점이다. 만약에 잔존하는 peroxidase가 많은 조직을 사용할 경우에는 과산화수소수를 쳐서 이를 날려버리는 quenching작업을 해야한다. 내가 구매한 primary antibody가 염색이 잘 안된다면 농도를 조정하고, conjugation 시간을 조정해야 한다. 그런데 논문에는 자세한 프로토콜 사용은 없고.... '나 이 항체 (정말 친절한 경우) 00배 딜루션 해서 썼다' 까지만 적혀져 있다. ㅋㅋㅋㅋㅋㅋㅋㅋ 그래서 똑같은 항체를 사더라도 내 조직에 맞게 잘 조정해야 한다는 점이 면역염색을 어렵게 만드는 것 같다.
IHC 프로토콜 (FFPE ABC IHC 기준)
1. 파라핀 임베딩 한 조직 슬라이드를 Deparaffin 시킨 후 DW에서 washing 한다.
여기에서 꼭 해야 하는 것은, 파라핀 슬라이드를 현미경으로 한 번 확인하는 것이다. primary antibody 비싸다. 그리고 IHC는 보통 이틀 걸린다. 시간도 많이 걸리고 시약도 비싸니까, 멀쩡하고 괜찮은 슬라이드를 사용할 수 있도록 신경쓴다.
2. Unmasking을 실시한다. 이는 포르말린으로 고정하고 파라핀에 embedding 하면서 뜨거운 고열로 인해서 변형된 단백질을 풀어주어 항원항체 결합 반응을 더 원활히 할수 있도록 해준다. 이때 unmasking을 하는 solution은 내가 쓰는 primary antibody에 따라 다르게 사용 된다. 보통은 citrated-based의 약산성(pH6.0)을 사용하지만, antibody에 따라서 triton-x와 같은 detergent로 녹여버리라는 것도 있고, proteinase K와 같은 효소를 이용하여 날려 버리는 것도 있고, 염기성 citrate를 사용해라고 하는 경우도 있다. 이를 잘 찾아보고 사용하면 된다.
보통은 unmasking solution을 넣고 전자렌지에다 끓여버린다. 면역 염색을 많이 하는 곳에는 압력밥솥이 있으며... 밥솥에다 쪄버린다.
3.DAB발색을 하는 경우에는 체내에 잔존하는 peroxidase를 날려주어 비특이 반응을 줄여주는 quenching을 거친다. 이는 과산화수소수를 사용하여 진행하며, 조직에 따라 농도와 시간을 달리한다.
4. blocking solution으로 blocking을 한다. antibody는 비특이적으로 여러군데에 결합할 수 있는데, 이를 방지하기 위함이다. 주로 Bovine serum albumin등이 사용된다. 단백질 표면에 있는 소수성의 chain을 가려주는 역할을 한다.
5. primary antibody를 친다. 항체 파는 회사들은 10분만 치면 된다는 식으로 게시글을 올려놓지만, 꼭 리뷰를 확인한다. primary antibody는 100ul에 100만원씩 한다. 비싸니까 날려먹으면 내 돈은 아니지만 아깝고, 주문하면 배달되는데 시간도 많이 걸리니 딜루션 비율과 reaction time은 후기를 꼼꼼히 확인한다. 대부분은 4도씨 냉장고에서 overnight 한다.
6. Biotinylated secondary antibody를 친다.
7. biotin과 결합할 수 있는 ABC solution ( strepavidin-HRP complex)를 친다.
8. DAB로 발색 시킨다. 이때 한장씩 조금씩 해보며, 되도록이면 타이머를 켜서 발색 시간을 동일하게 할 수 있도록 한다.
9.핵을 counter staining 한 다음에 Alchohol에서 Xylene으로 탈수 시킨뒤, mounting 한다.
'응용 > 면역학 Immunology' 카테고리의 다른 글
| Veterinary Immunology 수의 면역학 02.선천성 면역: 항원 인지 PAMP, DAMP, PRR (3) | 2021.08.03 |
|---|---|
| 항체의 종류와 역할 Antibodies: soluble antigen receptors (0) | 2021.07.27 |


댓글